王勇研究组在植物底盘系统中实现小檗碱从头合成新突破
2025年10月31日,中国科学院分子植物科学卓越创新中心、植物性状形成与塑造全国重点实验室、合成生物学实验室王勇研究组在Engineering期刊在线发表题为“Fine-Tuned Transcription Factor Engineering and Precursor Rewiring Drive Enhanced Production of Berberine in Nicotiana benthamiana”的研究论文。该研究首次利用植物底盘本氏烟草(Nicotiana benthamiana),完整重建小檗碱的生物合成全途径,实现了这一复杂天然产物的从头合成。
小檗碱是一种具有显著药理活性的苄基异喹啉类生物碱(BIAs),广泛应用于抗炎、抗菌、代谢性疾病治疗及神经保护等领域。开发其绿色、可持续的生产方式一直是合成生物学的研究热点。王勇研究组此前基于大肠杆菌底盘系统实现了小檗碱前体—(S)-四氢小檗碱的从头合成,创下微生物底盘合成原小檗碱的最高水平。然而,由于该类化合物的合成途径复杂且具有细胞毒性,进一步提升微生物合成效率仍面临巨大挑战。
为突破这一瓶颈,研究组充分利用植物特有的空间区室化与代谢稳态特性,系统探索复杂BIAs有效合成新策略。通过质体代谢重构与转录因子精细调控工程(Fine-Tuned Transcription Factor Engineering),团队在本氏烟草中实现了小檗碱的从头合成,建立了稳定高效的植物底盘系统,为基于植物底盘的BIAs及其他高值天然产物的绿色制造奠定了重要基础。
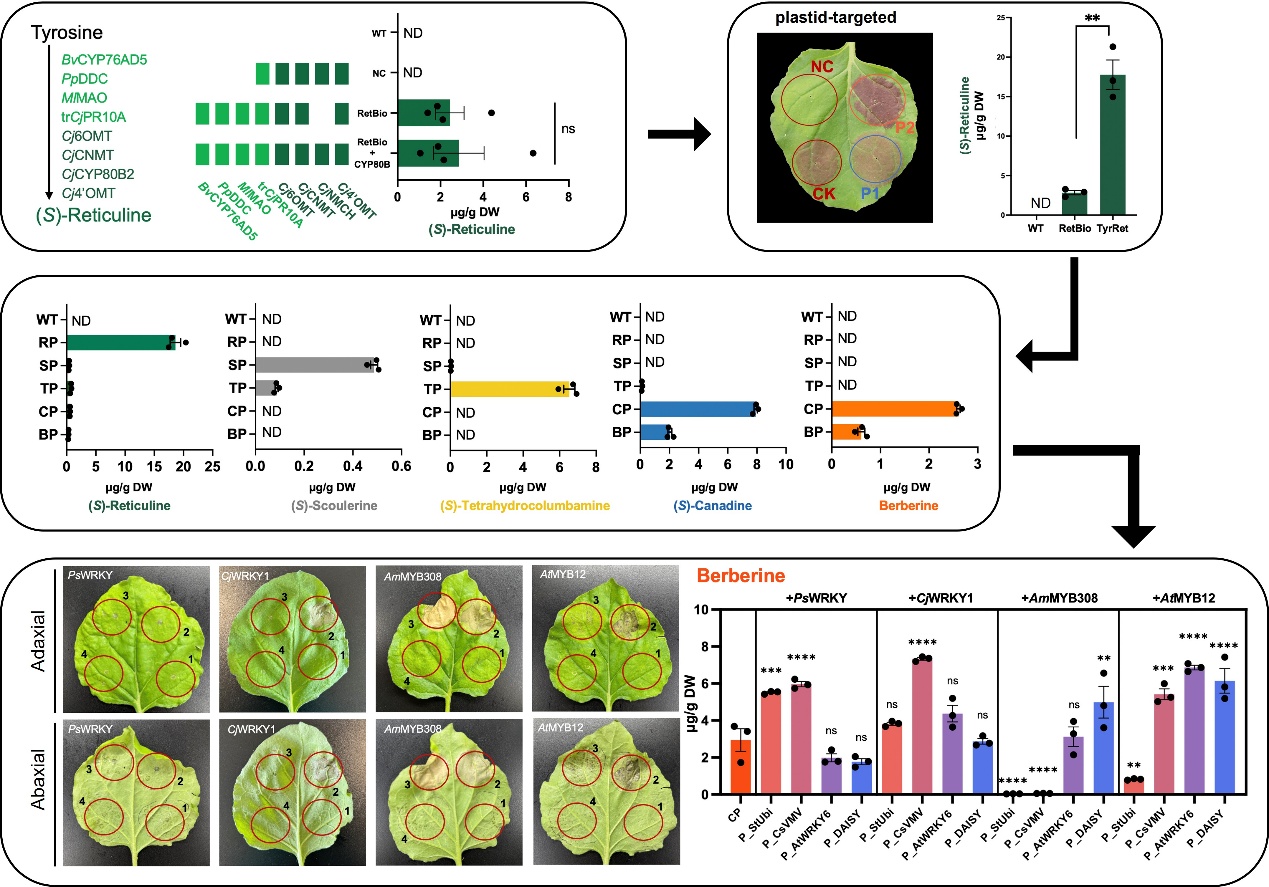
针对本氏烟草体系前体匮乏问题,团队重塑了质体与胞质中的L-酪氨酸供应。研究发现,利用质体信号肽Rs1A将大肠杆菌来源的抗反馈型TyrAfbr (CM2/PDH) 和TyrB(TAT同源酶)精准导入质体,显著增强L-酪氨酸合成通量。同时,通过引入甜菜酪氨酸羟化酶BvCYP76AD5、恶臭假单胞菌脱羧酶PpDDC 和藤黄微球菌单胺氧化酶MlMAO,构建高效的多巴胺和3,4-二羟基苯乙醛(3,4-DHPAA)合成通路,使关键中间体(S)-网状番荔枝碱产量提升6.26倍,达到17.76 μg·g⁻¹干重;在下游酶模块引入后,小檗碱积累达2.60 μg·g⁻¹。
尽管成功地重建了通路,非靶向代谢组学分析表明,莽草酸途径下游的主要竞争支路—苯丙烷代谢物大量积累。为进一步优化代谢平衡并缓解宿主胁迫,团队建立了基于弱启动子介导的转录因子精细调节系统。该策略有效调控了烟草中小檗碱的代谢通量,同时平衡了与宿主稳态,显著改善了传统强启动子驱动引发的坏死表型。将CjWRKY1表达从高水平降低至中等水平,成功消除了细胞毒性,并使小檗碱产量提升222%(至7.33 μg·g⁻¹)。转录组比较分析进一步揭示,转录因子可诱导内源性同源酶的表达,从而有效补充异源通路功能。最终,通过酶工程获得高活性 AmBBE1F398W/I431F突变体,协同调控后小檗碱产量进一步提升至13.91 μg·g⁻¹,经热处理(98 ℃,24 h)最终达到15.03 μg·g⁻¹干重。
该研究成果首次在植物底盘体系中实现小檗碱的从头合成,这是复杂BIAs异源合成领域的又一突破,为基于植物底盘的复杂天然产物的高效生物制造提供了样本。
中国科学院分子植物科学卓越创新中心田晨菲博士和张前博士为该论文并列第一作者,王勇研究员与刘海利副研究员为共同通讯作者。本研究获得国家重点研发计划、上海市科技重大专项及中国科学院先导B等项目资助。
论文链接:https://doi.org/10.1016/j.eng.2025.10.021
基于质体代谢重构和转录因子精细调控新策略实现本氏烟草中小檗碱从头合成