杨晟研究组挖掘高活性CRISPR转座酶用于正交多重编辑
2021年9月3日,国际学术期刊 Nucleic Acids Research在线发表了中国科学院分子植物科学卓越创新中心杨晟研究组完成的题为“Orthogonal CRISPR-associated transposases for parallel and multiplexed chromosomal integration”的研究论文。该研究挖掘到一种高活性新型CRISPR相关转座酶(CRISPR-associated transposases, CASTs)。
设计与调试微生物细胞工厂常需要中断一批基因和/或调试一批基因的最优剂量比。基于CRISPR-Cas9的基因组编辑工具受限于同源重组效率,难以同时编辑4个以上靶点,特别是基因整合,这就需要费时的多轮编辑。已发现有6种CAST可不依赖同源重组进行细菌染色体DNA整合。实验室前期将其中活性最高的一种部署为基于CRISPR-转座系统的多拷贝染色体整合工具(Multiple chromosomal integration by CRISPR associated transposase, MUCICAT),应用于重组蛋白质表达基因剂量优化(Zhang et al., ACS Synth Biol, 2020),并展示了其在代谢工程中多重基因中断这一优势(Zhang et al., CRISPR J, 2021)。
本研究进一步挖掘到来源于半透明假交替单胞菌KMM520(Pseudoalteromonas translucida KMM520)的第7种CAST,称为PtrCAST。其不仅在大肠杆菌中也具有多拷贝染色体编辑的高活性,且不受PAM限制,可以容忍除4个核苷酸的种子序列外的间隔序列错配。在测试的组合下,PtrCAST能与原MUCICAT正交使用,以各自的CRISPR 阵列将各自的负载DNA互不干扰地整合在大肠杆菌染色体上的5和2个位点。这一正交MUCICAT为细菌基因组编辑提供了一个强有力的工具。
中国科学院分子植物科学卓越创新中心杨晟研究员为本研究通讯作者,博士生杨思琪和张译文为共同第一作者。该研究得到国家自然科学基金和上海市科技重大专项的支持。
论文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab752/6363765
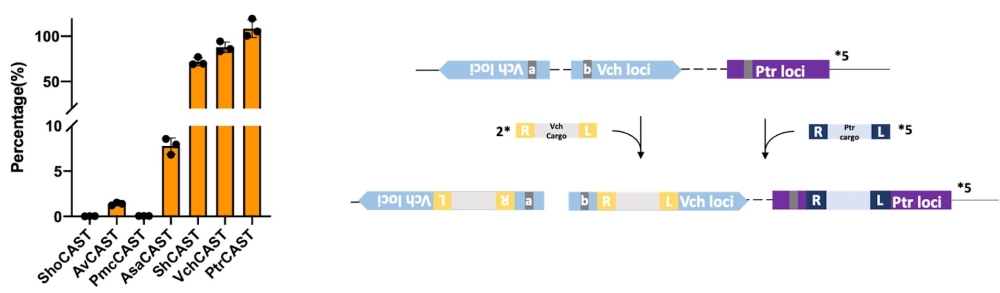
左图:7种CRISPR相关转座酶效率比较
右图:正交MUCICAT示意图