王四宝研究组揭示按蚊肠道共生菌抗疟的分子机制,为源头阻断疟疾传播提供新武器
2021年5月6日,中国科学院分子植物科学卓越创新中心王四宝研究团队在国际重要学术期刊Nature Microbiology《自然-微生物》上发表题为“A natural symbiotic bacterium drives mosquito refractoriness to Plasmodium infection via secretion of an antimalarial lipase” (一种肠道共生细菌通过分泌抗疟脂肪酶来驱动蚊子对抗疟原虫感染)的最新研究成果。该研究从我国主要疟疾媒介中华按蚊肠道内发现了具有天然抗疟活性的共生细菌—解脲沙雷氏菌(Serratia ureilytica)菌株Su_YN1,并深入揭示了该共生菌通过分泌抗疟蛋白脂肪酶AmLip杀灭疟原虫的分子机制。该项研究不仅为人们理解按蚊肠道菌抗疟机制提供了新的见解,也为从源头阻断疟疾传播提供了新武器。
疟疾是一种由疟原虫感染引发的寄生虫病,与艾滋病、结核病一并被世界卫生组织列为全球三大公共卫生问题。疟疾通过雌性按蚊叮咬吸血在人际间传播,主要流行于非洲、美洲、亚洲的热带和亚热带地区,全球约一半人口面临罹患疟疾的风险。我国曾经是疟疾流行最严重的国家之一,据记载早在3000多年前的商朝时期,疟疾就曾在我国和希腊等地区流行。 20世纪40年代间,我国每年约有3000万疟疾病例、30万人死亡。人类与疟疾历经长达几个世纪的斗争,可是全球疟疾发病率和致死率仍居高不下。据世界卫生组织(WHO)报告,2014-2019年间全球疟疾病例显逐年上升趋势,每年约有2-3亿人感染疟疾、约60万人因此丧生,严重威胁民众的生命健康和全球公共卫生安全。随着全球化和人员往来的频繁,近年来我国每年有3000多例境外输入性疟疾病例,并呈上升趋势,输入疟疾再传播的风险仍然持续存在。
控制源头、切断传播途径,是传染病防控的治本之策。尤其在疟原虫对青蒿素在内的所有一线抗疟药均已产生耐药性的情况下,从源头控制媒介蚊虫数量,阻断和预防疟疾传播,显得尤为重要。喷洒化学农药曾是杀蚊的有效手段,然而随着蚊虫抗药性和环境污染等问题日益突出,研发阻断疟疾传播的新方法迫在眉睫。
蚊虫是大自然食物链中的重要组成部分,彻底消灭蚊子来根除疟疾既不现实也对生态无益。抑制蚊子体内的疟原虫或使蚊子对疟原虫产生抵抗力,被认为是阻断疟疾传播的一种新策略。疟原虫通过蚊虫叮咬吸取疟疾患者的血液时进入蚊子肠道,绝大多数疟原虫在按蚊中肠肠腔内被抑制,因此按蚊中肠是疟原虫在蚊体内发育的最大屏障,是歼灭蚊子体内疟原虫的绝佳战场。近来研究表明,肠道共生菌在按蚊抗疟上扮演关键角色,是按蚊中肠屏障的重要生物因子。然而,人们对肠道共生菌抗疟的分子机制了解甚少。
在该研究中,研究团队首先通过对我国不同地区往年疟疾病例流行病学调查结果进行分析,发现位于中缅边境的云南腾冲地区本地感染疟疾病例显著低于输入性疟疾病例数。通过体外人工膜饲血感染系统,测定并比较不同地区中华按蚊对间日疟原虫的易感性,发现腾冲地区中华按蚊对间日疟原虫具有较高的抗性。肠道共生菌是一类与宿主昆虫在长期互作过程中形成稳定共生关系的肠道微生物,对宿主许多生理功能具有重要影响,是宿主健康的守护者。为了探究肠道共生菌是否在中华按蚊抗疟过程中发挥重要作用,研究人员首先建立了“蚊虫肠道共生细菌的富集分离方法”,然后综合运用高通量测序法和体外培养方法,对云南腾冲(YN)、江苏无锡(JS)和辽宁丹东(LN)三个代表性地区野外采集的中华按蚊肠道共生菌群的多样性和结构组成进行比较分析,发现沙雷氏菌属类细菌Serratia spp.是我国中华按蚊的肠道核心菌群(core gut microbiota)(图1)。通过测定比较YN按蚊体内不同菌株的抗疟活性,鉴定到一株解脲沙雷氏菌(Serratia ureilytica) Su_YN1能够高效抑制恶性疟原虫和伯氏疟原虫在按蚊肠道内发育和感染。
深入研究发现Su_YN1通过分泌产生胞外活性物质直接杀灭疟原虫。通过提取分离代谢产物活性成分、测定其抗疟活性,发现抗疟活性成分是蛋白类物质。提取胞外蛋白质,经质谱分析(使用一株无抗疟活性的解脲沙雷氏菌Su_JS1作为对照菌株),鉴定蛋白组分,并对Su_YN1特有和高表达的差异蛋白编码基因分别进行敲除,测定突变体抗疟活性变化,最终发现Su_YN1通过分泌一种脂肪酶蛋白AmLip来裂解疟原虫(图2-3)。该研究首次揭示了肠道共生菌通过分泌抗疟蛋白活性物质直接杀灭疟原虫的分子机制。此外,该研究还发现另一株粘质沙雷氏菌(Serratia marcescens) Sm_YN3通过激活按蚊肠道Toll免疫通路来间接抑制疟原虫。研究发现,两株抗疟共生细菌在蚊群内兼具水平和垂直散播能力,不仅能通过雄蚊交配水平传播给雌蚊,还可经雌蚊产卵垂直传给后代,从而使该共生菌快速扩散至蚊群中。
该研究综合运用疾病流行病学调查、微生物组学、代谢组学、蛋白质组学、比较基因组学、反向遗传学、细胞生物学、免疫学、寄生虫学等多学科交叉研究手段,深入揭示了中华按蚊核心肠道共生菌群组成,发现了肠道共生细菌在中华按蚊抗疟上发挥至关重要的作用;揭示了肠道共生细菌协同媒介按蚊抗疟的互作分子机制(图4),为肠道共生菌协助按蚊抗疟的因果关系提供了直接证据,拓展了人们对按蚊抗疟机制的理解。该研究发现的兼具天然抗疟和快速扩散能力的肠道共生菌,为从源头遏制疟疾流行提供了绿色防控新武器,并对利用共生菌阻断疟疾传播的防控实践具有极大的推动作用。
该研究是王四宝研究团队继发展基于表达抗疟效应分子构建工程肠道菌来阻断按蚊传播疟疾新策略以来(PNAS, 2012; Science, 2017),在相关研究方向上取得的又一重要成果。值得一提的是,该抗疟蛋白对寄生于人红细胞内(红内期)的疟原虫也有很好的杀疟活性(图3),是治疗疟疾的潜在候选药物(已申请专利)。由于该抗疟效应蛋白具有多时期杀疟活性,将有望在阻断传播和疟疾治疗上发挥多重功效。
王四宝研究组的博士后高涵和博士生白亮为该论文的共同第一作者,王四宝研究员为通讯作者。研究组博士生蒋永茂和王历历为共同作者。该研究得到了来自包括云南腾冲市疾病预防控制中心李胜国主任和李希尚技术员,江苏省寄生虫病防治研究所曹俊研究员和朱国鼎博士,中国疾病预防控制中心寄生虫病预防控制所王多全研究员,中国科学院上海巴斯德研究所江陆斌研究员及其实验室博士生黄正辉,美国约翰霍普金斯大学Marcelo Jacobs-Lorena教授及其实验室博士后黄威,以及本中心的詹帅研究员等在内的多方合作与鼎力支持。该研究受到国家自然科学基金、中国科学院、科技部等项目资助。
文章链接:https://dx.doi.org/10.1038/s41564-021-00899-8
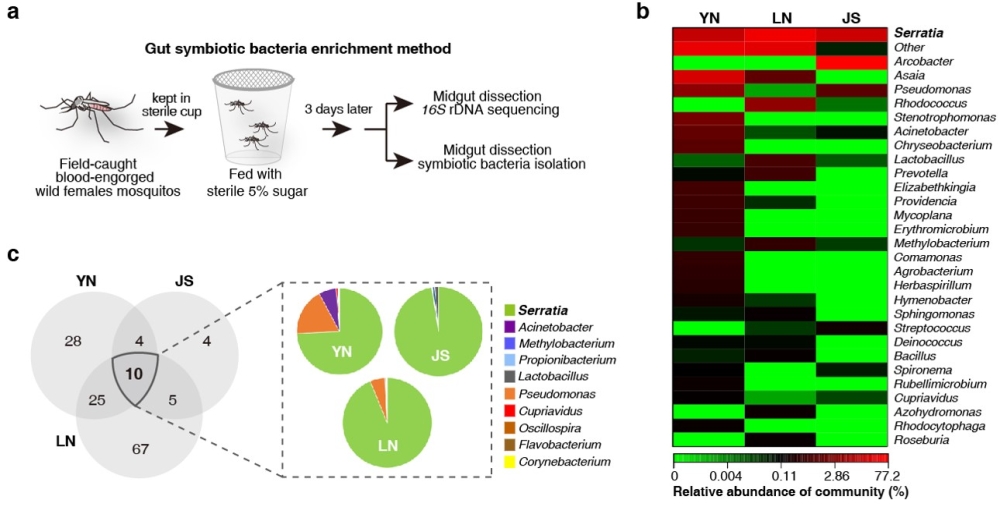
图1. 中华按蚊肠道核心共生菌群
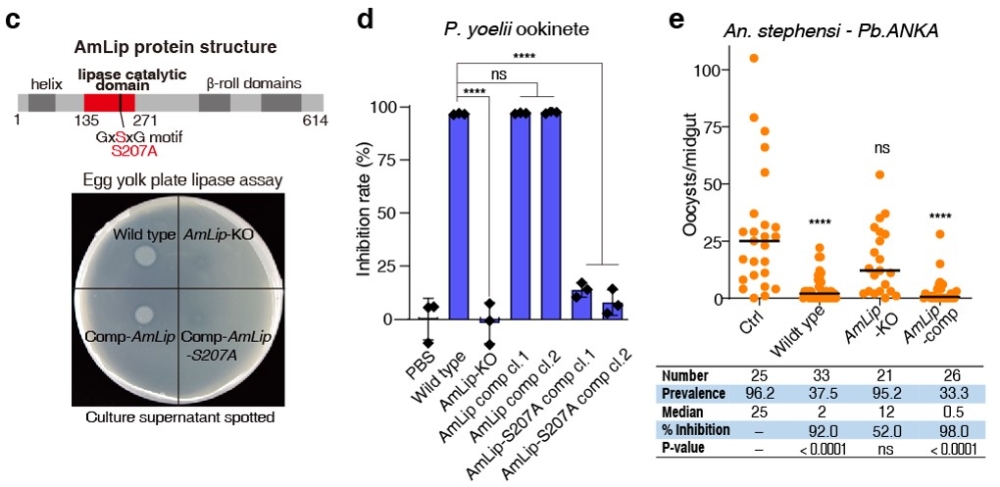
图2. Su_YN1通过分泌抗疟蛋白脂肪酶AmLip杀灭疟原虫
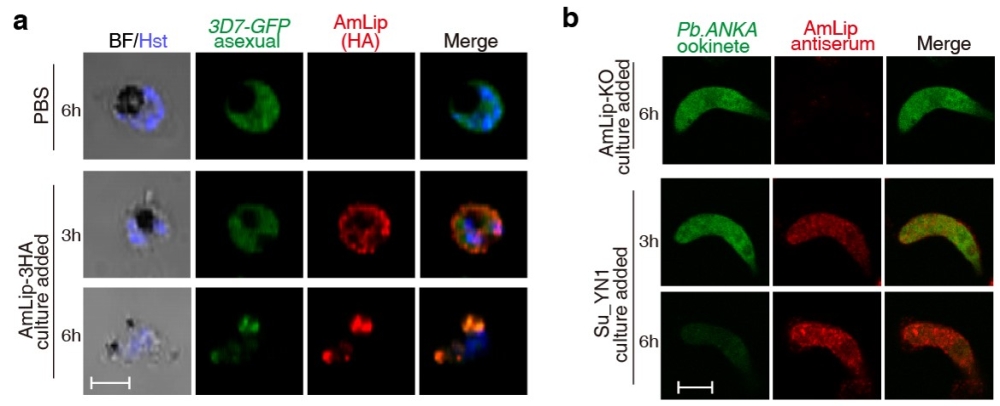
图3. 抗疟蛋白AmLip对寄生于人体红细胞内和蚊子肠道内的疟原虫均具有杀灭活性
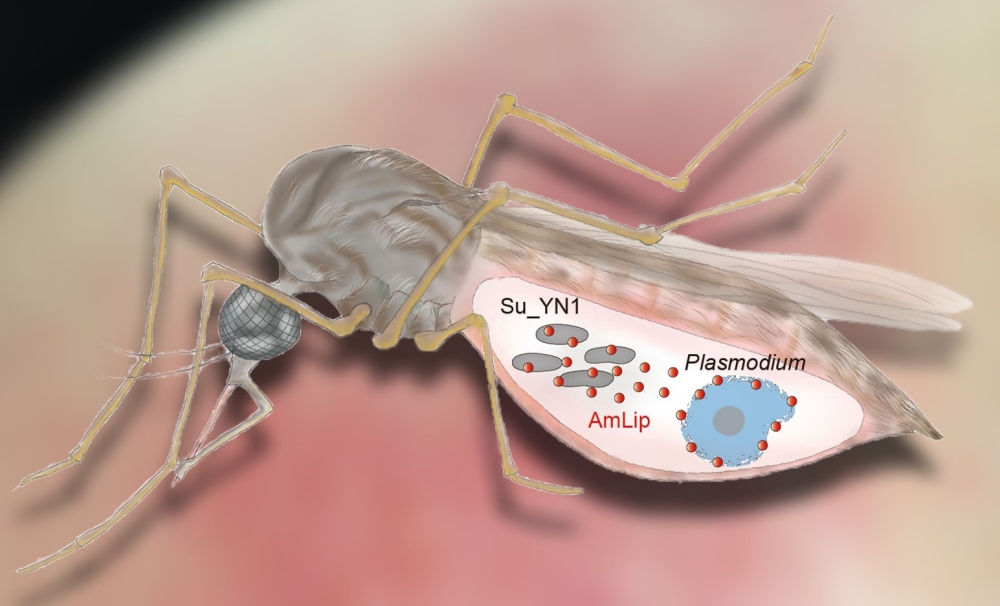
图4. 按蚊共生菌Su_YN1分泌抗疟蛋白脂肪酶AmLip杀灭疟原虫示意图