姜卫红研究组发现肠道梭菌中新型黄酮还原酶及其生理功能
2021年 2月4日,国际学术期刊Nature Communications在线发表了中国科学院分子植物科学卓越创新中心姜卫红研究组题为“Discovery of an ene-reductase for initiating flavone and flavonol catabolism in gut bacteria”的研究论文。该研究发现了来源于肠道微生物的一种新型烯还原酶——黄酮还原酶,并揭示其在代谢黄酮和黄酮醇这两类药/食来源化合物过程中的关键作用以及对肠道菌群微生态的影响。
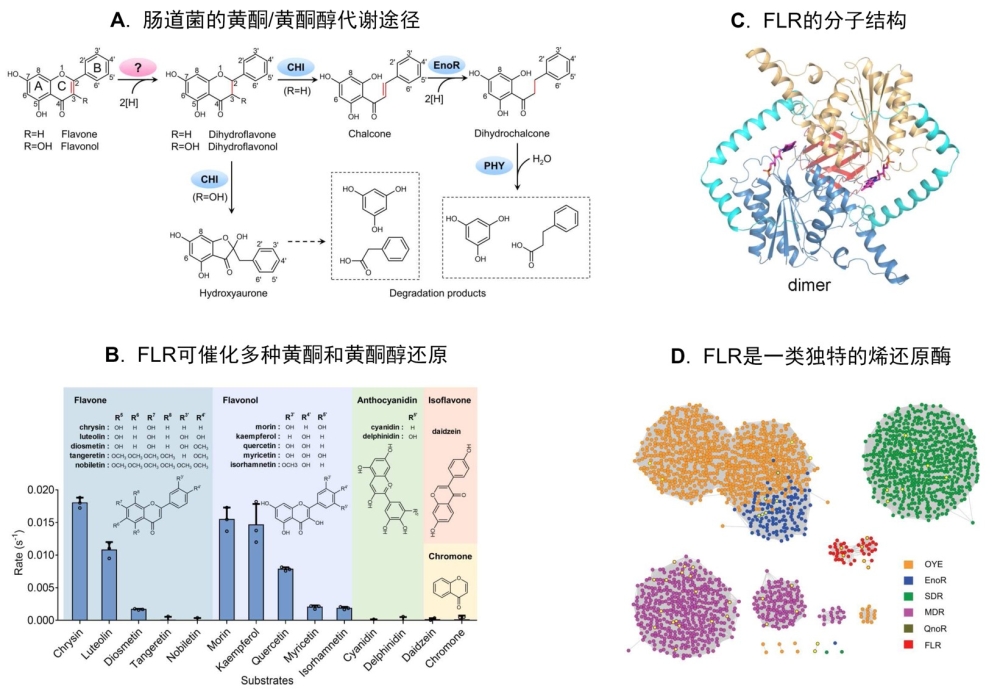
肠道微生物与人类长期共存,协同进化,具备了强大的代谢食源和药源物质的能力,与人体的营养和健康密切相关。黄酮类化合物是植物合成的最主要的多酚类天然产物,具有重要的生理和药用活性,它们不仅在人类的日常饮食中广泛存在,而且是许多临床药物的来源,具有抗氧化、抗心血管疾病和抗肿瘤等功效,可谓“药食同源”。人体肠道菌群可代谢黄酮类化合物,形成功能各异的活性物质,亦可发生转化而影响其生物利用度,因此解析代谢途径是认识这些过程的基础。然而,黄酮类化合物在肠道微生物中的代谢机制目前并不十分清晰。其中,最主要的两类化合物——黄酮和黄酮醇代谢途径中负责起始反应的关键酶尚未被发现和鉴定。
在该研究中,作者聚焦于一种可代谢黄酮类化合物的肠道菌——解黄酮梭菌Clostridium orbiscindens,通过生物信息学分析结合遗传与生化研究方法,鉴定和表征了该菌中起始黄酮代谢的关键酶,命名为黄酮还原酶(Flavone reductase, FLR)。进一步研究发现,该酶不仅能够催化黄酮的降解和转化,对另一大类黄酮类化合物——黄酮醇也有同样的催化活性。FLR是迄今为止唯一报道的可催化黄酮和黄酮醇C环结构上C2=C3键加氢生成二氢黄酮和二氢黄酮醇的还原酶,它启动了整个代谢途径中的关键反应,也是生成免疫激活剂脱氨基酪氨酸的重要一步。该酶底物谱较为宽泛,与已知的烯还原酶不同,它不依赖NAD(P)H作为电子供体,并且缺乏在大多数烯还原酶中保守的组氨酸和酪氨酸残基。为了深入解析FLR的结构与功能关系及分子机理,研究组通过合作获得了FLR蛋白及其与多种底物的共结晶,分析确定了其活性中心的构象以及结合底物分子的活性口袋位置,发现结构C端约100个氨基酸残基决定该酶催化功能的特异性。同时,对FLR的关键氨基酸残基进行定点突变,鉴定了影响酶活性的重要位点。基于上述研究,提出了FLR不依赖NAD (P) H催化黄酮和黄酮醇C2=C3键亲核加成的分子机制。
既然FLR能够启动黄酮代谢,它在肠道中发挥怎样的生理生化功能?作者随后分析了它对食源和药源物质代谢的能力。由于C. orbiscindens目前还没有遗传操作系统,因此选择另一株可操作的肠道梭菌——永达尔梭菌Clostridium ljungdahlii进行FLR的功能测试。结果显示,含有FLR的野生型菌株对食物源的多种黄酮类化合物(如芹菜素、槲皮素)以及作为药物的黄酮类制剂(如香叶木素和黄芩素)均具有代谢转化能力,而flr基因突变株则不能代谢这些化合物,从而证明了FLR在肠道梭菌利用食物和药物源黄酮类化合物的过程中发挥的重要作用。此外,特定肠道菌群的生长竞争实验还表明,FLR赋予宿主菌在面临黄酮胁迫压力时的生长优势。
种系发育分析显示,FLR同源基因存在于不同的微生物门类(如细菌,古菌及真菌)中,且主要分布于黄酮丰富的生境里。进一步的宏基因组学分析发现,flr基因在不同人群中的肠道菌中广泛存在,预示其作用具有普遍性。综上,该研究发现并鉴定了一种新型烯还原酶,填补了肠道微生物代谢黄酮类化合物途径中的一个关键缺口,为深入认识和理解人体对这类药食同源化合物的转化利用提供了借鉴。
博士研究生杨高华、洪森和杨朋洁为该论文的并列第一作者,顾阳研究员和姜卫红研究员为共同通讯作者。该研究得到了张鹏研究组、王勇研究组的大力支持,并获得国家自然科学基金委项目的资助。
文章链接:https://www.nature.com/articles/s41467-021-20974-2