肖友利研究组、赵国屏研究组与青岛能源所等团队合作阐明了利福霉素生物合成新机制
结核病不仅有导致大量人类死亡的历史事件,而且至今仍是危害公共健康的顽固性呼吸道传染病。利福霉素类化合物是由地中海拟无枝酸菌产生的一类具有广谱抗菌作用的抗生素,对结核杆菌、麻风杆菌、链球菌、肺炎球菌等革兰氏阳性细菌,特别是耐药性金黄色葡萄球菌具有很强的拮抗作用,同时对某些革兰氏阴性细菌也有效果。由天然产物利福霉素SV或利福霉素B进行化学半合成的利福平、利福喷丁、利福布丁等药物进入了世界卫生组织的基础药物目录,作为一线抗结核药物挽救了数以万计结核病人的生命。自1957年首次发现以来,利福霉素的生物合成途径一直是生物化学家们的研究热点。尽管前期利用同位素标记和基因敲除(敲入)等方法已阐明其生物合成途径中的大部分环节,但利福霉素SV是如何转化为利福霉素B的这个关键环节却长时间困扰着科学界。
日前,由中国科学院青岛生物能源与过程研究所(青岛能源所)李盛英团队,与中科院分子植物科学卓越创新中心/植物生理生态研究所赵国屏院士和肖友利研究组,以及中国科学院上海有机化学研究所(上海有机所)唐功利团队的多名学者合作,在国际上首次阐明了利福霉素SV转化为利福霉素B的详细生物合成途径及酶催化反应机制,相关成果于6月14日已在线发表于最新出版的 Nature Communications期刊上。
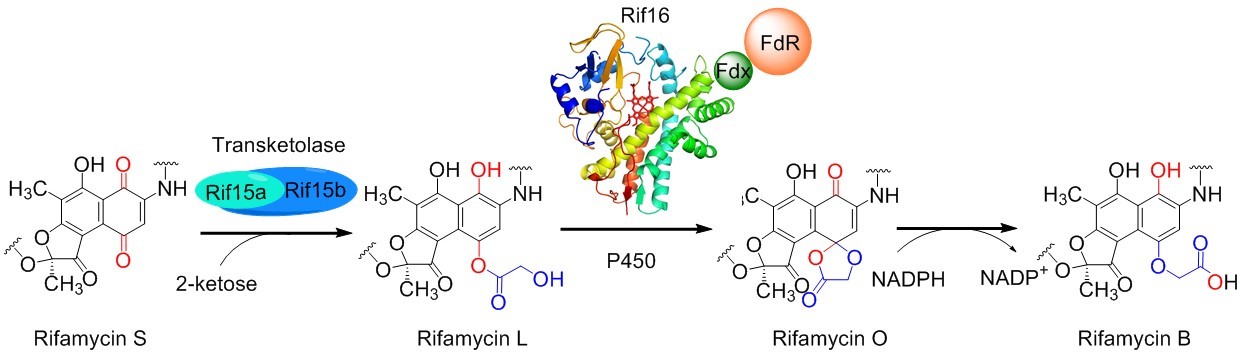
基于2011年赵国屏院士研究组通过分子遗传学方法确认关键基因Rif15/16负责利福霉素SV到B转化的体内研究工作基础,本工作中研究人员成功在大肠杆菌中异源表达得到可溶性的转酮酶Rif15和细胞色素P450单加氧酶Rif16,在体外通过酶活重建、产物结构表征、13C标记实验和Rif16晶体结构解析彻底阐明了利福霉素SV转化为利福霉素B的生物合成途径及这两个酶的功能和催化机制,改写了Ghisalba等在36年前提出的“旧模型”(J. Antibiot. 35, 1982: 74-80)。研究团队发现,利福霉素SV首先在有氧条件下可自发被氧气化学氧化成利福霉素S,进而在转酮酶Rif15的作用下将2-酮糖的一个C2基团转移至利福霉素S上并重排生成含有C-O酯键结构的利福霉素L。接着P450单加氧酶Rif16拔取利福霉素L C-39位羟基上的氢原子,形成的氧自由基进攻临近芳环C-4位形成五元环结构,然后再经一系列电子重排和第二次C-1位置酚羟基上氢原子的拔取,生成不稳定的中间体化合物利福霉素O。该化合物在电子供体NADPH存在条件下,迅速被水解还原形成稳定的终产物利福霉素B。在此过程中,转酮酶Rif15表观上催化一个独特的C-O成键反应(通过常规的C-C成键和非常规重排形成);而P450单加氧酶Rif16则通过一个五元环的介导,成功实现了一种十分罕见的“酯醚转化”反应。这两个全新催化机制的发现,进一步拓宽了转酮酶和P450单加氧酶这两种常见生物催化剂的催化反应类型,加深了领域内对这两种酶的认识。该项研究的成功还将为进一步利用合成生物学方法有效进行新型利福霉素发现和工业菌种改造,进一步提升利福霉素的产量提供全新的理论依据。
青岛能源所助理研究员齐飞飞和中科院分子植物科学卓越创新中心/植物生理生态研究所雷超博士为本论文的共同第一作者。李盛英研究员和肖友利研究员为论文的共同通讯作者。该研究获得了山东省合成生物学重点实验室、山东省自然科学基金重大基础研究计划、中国科学院前沿重点研究项目和大科学计划培育项目、国家自然科学基金以及上海市科学技术委员会基金的支持。
文章链接:https://www.nature.com/articles/s41467-018-04772-x